
유럽공동체인증(CE)은 유럽에 안경류 제품을 수출하는 기업들은 반드시 거쳐야 하는 필수 절차다. 최근 CE 인증 절차에 대리인 선임, EUDAMED 등록, 시판 후 사후 관리 등의 절차가 추가 되면서 유럽 수출을 목표로 하는 기업들은 변경된 절차를 인지하고 유럽 시장에 진출해야 할 것으로 보인다.
CE 인증은 유럽연합 시장 내 유통되는 제품 중 소비자의 건강, 안전, 위생 및 환경보호 차원에서 위험성이 내포돼 있다고 판단되는 제품에 적용되는 필수 인증 제도다.
CE 마킹 종류에는 적합성 선언(DoC, Declaration of Conformity)과 적합성 인증(CoC, Certificate of Conformity)이 있다. 적합성 선언은 제조자 또는 제조자의 대리인이 기술문서를 작성하고 스스로 적합성을 선언한 후 CE 마킹을 하는 것을 뜻하고, 적합성 인증은 인증심사기관이 기술문서 및 품질 시스템을 검토하고 관련 법규 및 규격 등에 대한 적합성 심사를 통해 인증 후 마킹 하는 방식이다.
기존 CE MDD(Directive 93/42/EEC for Medical device)는 기술문서 작성, DoC선언, CE마킹 및 EU수출 순이었지만, 변경된 CE MDR(Medical Device Regulation (EU) 2017/745)은 유럽대리인 선임, EUDAMED 등록(SRN채번, UDI부여) 등의 절차가 추가됐다.
MDR 주요 변경사항으로는 의료기기의 등급 재분류(치료목적 외 의료기기 규정신설), 제조자 책임강화(EUDAMED 등록:SRN 채번, UDI 코드), 엄격한 임상증거 요구(임상평가보고서), 시판 후 시장 감시 강화(PSUR, 정기 안정성 업데이트 보고서 제출), MDR 품질경영시스템(QMS) 추가 요구사항 반영 등이다.
기존 MDD 인증서는 2024년 5월 27일부터 효력이 만료되며, MDD 인증서 효력이 만료 되더라도 MDD에 따라 이미 유럽시장에서 유통되고 있는 제품은 2025년 5월 27일까지 사용이 가능하다. MDR 규정에 따라 품질경영시스템 및 기술문서를 충족한다면 전환기간에 상관없이 적합성 선언(DoC)이 가능하다.
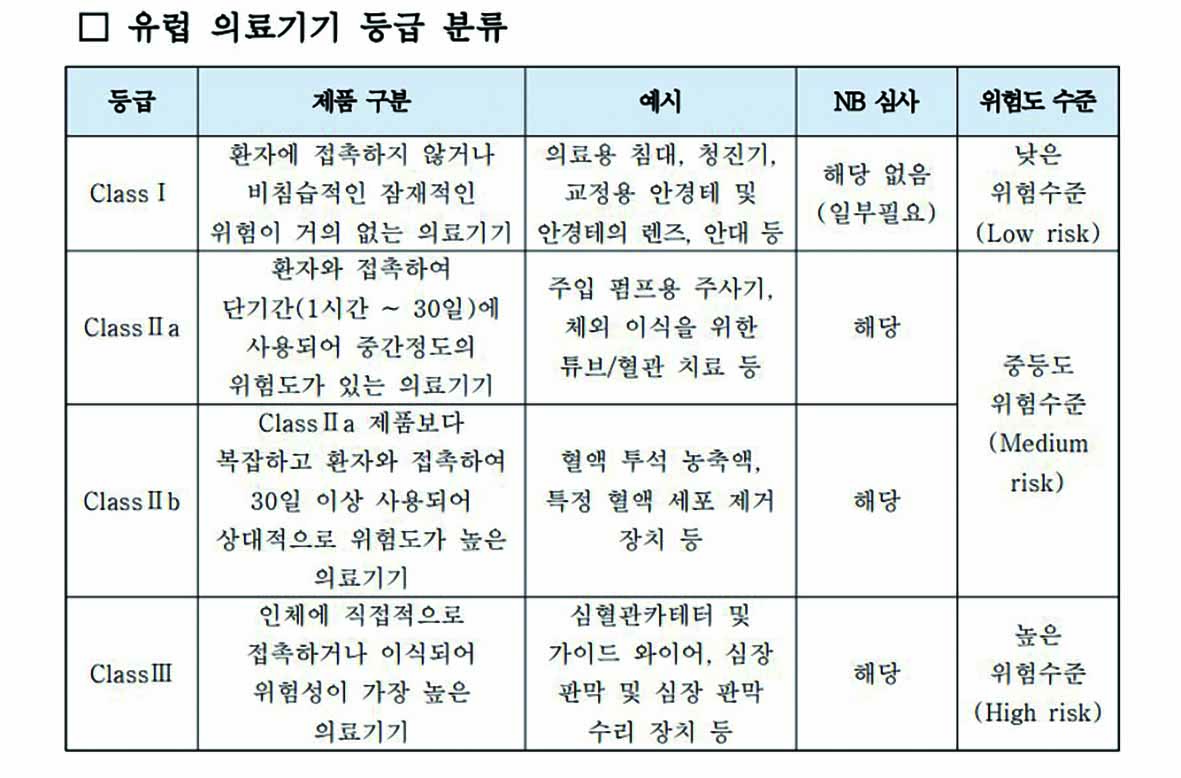
유럽 의료기기 규정은 총 10개 장에 17개의 부속서가 포함돼 있다. 유럽 의료기기 등급 분류에 따르면 무도수 안경테는 환자에 접촉하지 않거나 비침습적인 잠재적 위험이 거의 없는 의료기기 단계인 ‘ClassⅠ’에 속한다. 단, 도수용 렌즈가 삽입된 안경테 및 도수용 렌즈는 환자와 접촉해 단기간에 사용돼 중간 정도의 위험도가 있는 의료기기 등급인 ‘Class Ⅱa’에 속한다.
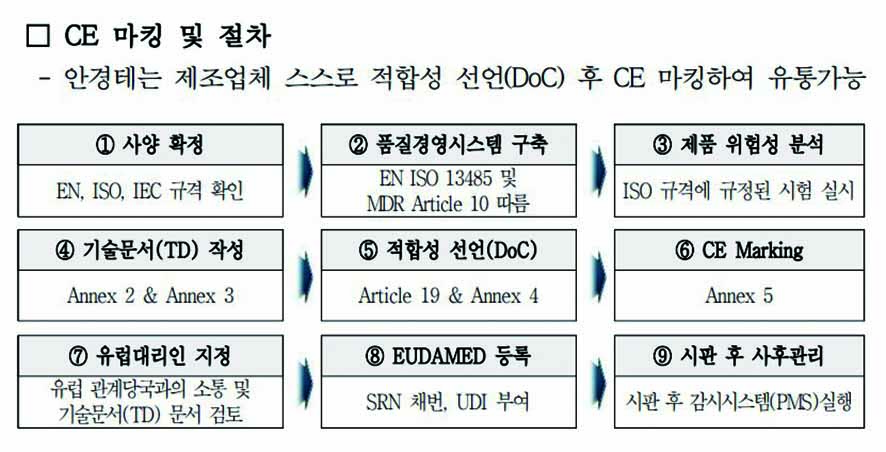
안경테 제품 CE MDR 절차는 사양확정, 품질 경영시스템 구축, 제품 위험성 분석, 기술문서 작성, 적합성 선언, CE 마킹, 유럽 대리인 지정, EUDAMED 등록, 시판 후 사후 관리 순으로 진행된다. 제3국의 경우 유럽 대리인을 반드시 선임해야 하며, 제조사는 기술문서 및 EU적합 선언서를 유럽 대리인에게 제공할 수 있어야 한다.
또 제조사 내 규제전문가(PRRC)를 1명 이상 선임하여야 하나 조직규모에 따라 지정하지 않을 수 있다.(종업원 수 50명 미만 및 연매출 1천만 유로 이하 제외) UDI(의료기기 고유식별코드) 시행일은 2025년 05월 26일부터이며, 제품 유통(시판) 후 시장 감시 강화로 인해 사후관리 관련한 기술문서 또한 중요하다.
국내에 품질경영시스템 및 기술문서 작성 대행, 제품시험 평가를 할 수 있는 CE 관련 컨설팅 및 시험 기관으로는 한국화학융합시험연구원(KTR) 글로벌인증센터 (02-2164-0022), TUV SUD Korea (02-3215-1114), SGS Korea (02-790-4500), iCMC((주)해외인증경영센터 (02-2028-3111~3), U.S 인증원 (02-529-4790), 국제제품인증연구원 (031-8015-2940~1) 등이다.

