식약처, 제품추적성 더 높일듯
시력보정용 안경도 보고 대상
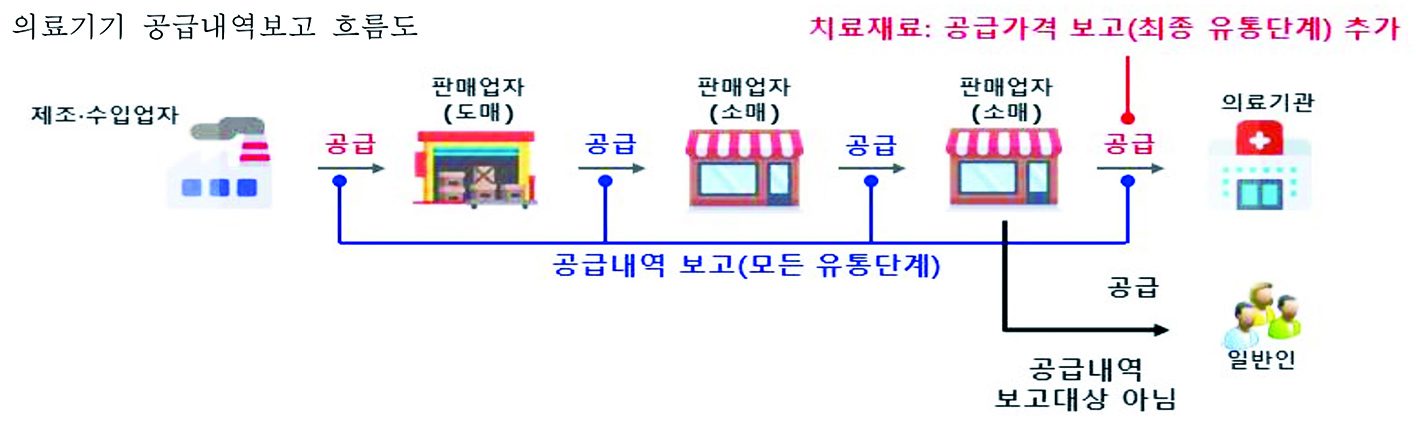
식품의약품안전처는 지난 2020년부터 의료기기 유통구조의 투명성 및 위해 제품 추적성을 높이기 위해 제조 수입 유통 단계별 의료기기 공급내역 보고를 의무화한 ‘의료기기 공급내역 보고 제도’를 시행하고 있다.

이 제도는 의료기기 제조 수입 판매 임대업자가 의료기기 판매 임대업자 및 의료기관에게 유통한 경우 공급자 정보, 제품정보 등을 정보시스템을 통해 보고하는 제도다. 인체 이식 의료기기와 같이 위험도가 높은 4등급 의료기기부터 단계적으로 시행하고 있다. 2023년도 7월1일부터는 인체에 잠재적 위해성이 없는 의료기기 1등급까지도 공급내역 보고를 시행한다. 앞으로 모든 등급의 의료기기가 공급 내역 보고를 하게됐다. 만약 공급내역을 보고하지 않은 경우 판매업무 정지 15일 및 과태료 50만원 등의 처분을 받게 된다.
국내 안경업계에서 유통되는 1등급 의료기기로 대표적인 품목이 ‘안경렌즈’와 ‘시력 보정용 안경’이다. 앞으로 관련 기업들은 공급내역 보고를 해야 할 것으로 보인다. 의료기기 공급내역보고 방법은 https://udiportal.mfds.go.kr/udi 사이트 접속, 계정신청, 로그인, 기초정보관리(거래처 관리-거래처 등록), 공급내역관리(보고자료 등록공급내역보고-공급내역보고현황)순으로 진행하면 된다.
한편 지난 2020년 7월부터 시행된 4등급 의료기기는 인체에 영구적으로 이식되는 의료기기로 중추신경, 심장, 중앙혈관계 등에 직접 접촉되어 사용되는 의료기기다. 동물의 조직 또는 추출물을 이용하거나 안전성 등의 검증을 위한 정보가 불충분한 원자재를 사용한 의료기기. 고도의 위험성을 가진 의료기기다.
3등급 의료기기는 인체에 일정 기간 삽입되어 사용 되어지거나 잠재적 위험성이 높은 의료기기로 치과용 임플란트, 무릎관절, 투석기, 인공뼈, 인공 호흡기, 척수마취용침, 심장충격기, 레이저수술기 등이 있다. 2등급 의료기기는 인체에 위험성은 있으나 생명의 위험 또는 중대한 기능장애에 직면할 가능성이 적어 잠재적 위험성이 낮은 의료기기다. 대표적으로는 콘택트렌즈를 비롯해 환자감시장치, 의료영상 전송장치 소프트웨어, 혈관내 튜브 및 카테터, 의안, 의료용 진동기 등이다. 1등급 의료기기는 인체에 직접 접촉되지 않거나, 접촉되더라도 잠재적 위험성이 거의 없고, 인체에 미치는 영향이 경미한 의료기기다. 대표적으로 안경렌즈, 유리주사기, 전동식 수술대, 전동식 의료용침대, 수동식 의료용침대, 시력보정용안경, 레이저방어용 안경 등이다.
한편 식약처는 “축적된 공급내역 빅데이터 등을 활용 분석해 의료기기 안전관리 체계를 지속적으로 개선해 갈 것”이라고 밝혔다

